肿瘤科
中国结直肠癌诊疗规范(2020年版)
核心提示: 中国结直肠癌诊疗规范(2020年版)
中国结直肠癌诊疗规范(2020年版)
中华人民共和国国家卫生健康委员会
一、概述
我国结直肠癌的发病率和死亡率均呈上升趋势。2018中国癌症统计报告显示,我国结直肠癌发病率和死亡率在全部恶性肿瘤中分别位居第3位和第5位,新发病例37.6万例,死亡病例19.1万例;城市远高于农村,且结肠癌发病率上升显著,多数患者在确诊时已属于中晚期。
通过筛查可预防和早期诊断结直肠癌。在广州、上海、天津、北京等地开展的对全市年龄>50岁及高危人群的结直肠癌筛查结果显示,结直肠癌发病率持续升高,筛查可提高早诊率,降低病死率。主要方法包括根据年龄、家族史、大便潜血检查等筛选出高风险人群,继而进行内镜筛查。
结直肠癌诊疗过程可能涉及手术、化疗、放疗、影像学评估、病理学评估、内镜等诊疗手段。研究结果显示,多学科综合治疗模式可提高结直肠癌诊疗水平。为进一步规范我国结直肠癌诊疗行为,提高医疗机构结直肠癌诊疗水平,改善结直肠癌患者预后,保障医疗质量和医疗安全,特制定本规范。
二、诊断
2.1 临床表现
早期结直肠癌可无明显症状,病情发展到一定程度可出现下列症状。
(1)排便习惯改变。
(2)大便性状改变(变细、血便、黏液便等)。
(3)腹痛或腹部不适。
(4)腹部肿块。
(5)肠梗阻相关症状。
(6)全身症状,如贫血、消瘦、乏力、低热等。
2.2 疾病史和家族史
(1)结直肠癌发病可能与以下疾病相关:溃疡性结肠炎、结直肠息肉、克罗恩病、血吸虫病等,应详细询问患者相关病史。
(2)遗传性结直肠癌发病率约占结直肠癌总体发病率的6%,应详细询问患者相关家族史,包括遗传性非息肉病性结直肠癌、家族性腺瘤性息肉病等。
2.3 体格检查
(1)一般状况评价,了解全身浅表淋巴结特别是腹股沟及锁骨上淋巴结的情况。
(2)腹部视诊和触诊,检查有无肠型、肠蠕动波,腹部是否可触及肿块;腹部叩诊及听诊,了解有无移动性浊音及肠鸣音异常。
(3)直肠指检:对疑似结直肠癌者必须常规行直肠指检。了解直肠肿瘤大小、形状、质地、占肠壁周径的范围、基底部活动度、下缘距肛缘的距离、向肠外浸润情况、与周围器##官的关系、有无盆底种植等。同时观察指套有无血染。
(4)三合诊:对女性直肠癌患者,如怀疑肿瘤侵犯阴道壁,推荐行三合诊,了解肿块与阴道后壁的关系。
2.4 实验室检查
(1)血常规:了解有无贫血。
(2)尿常规:观察有无血尿,结合泌尿系统影像学检查了解肿瘤是否侵犯泌尿系统。
(3)大便常规:注意有无红细胞、白细胞。
(4)大便隐血试验:对消化道少量出血的诊断有重要价值。
(5)血生化、电解质及肝肾功能。
(6)结直肠癌患者在诊断和治疗前,评价疗效和随访时必须检测外周血癌胚抗原、CA19-9;有肝转移患者建议检测甲胎蛋白;疑有腹膜、卵巢转移患者建议检测CA125。
2.5 内镜检查
直肠镜和乙状结肠镜适用于病变位置较低的结直肠病变。
疑似结直肠癌患者均推荐行全结肠镜检查,但以下情况除外。
(1)一般状况不佳,难以耐受。
(2)急性腹膜炎、肠穿孔、腹腔内广泛粘连。
(3)肛周或严重肠道感染。
内镜检查报告必须包括:进镜深度,肿物大小、距肛缘距离、形态、局部浸润的范围,对可疑病变必须行活检。
由于结肠肠管在检查时可能出现皱缩,因此内镜下所见肿物下缘距肛缘的距离可能存在误差,建议结合CT、MRI或钡剂灌肠明确病灶部位。
2.6 影像学检查
2.6.1 常用检查方法
(1)CT:推荐行胸部+全腹+盆腔CT增强扫描,用于以下几个方面。
①结肠癌TNM分期:随访中筛查结直肠癌吻合口复发及远处转移。
②判断结肠癌原发灶及转移瘤的新辅助治疗、转化治疗的效果。
③鉴别钡剂灌肠或内镜发现的肠壁内和外在性压迫性病变的内部结构,明确其性质。
④有MRI禁忌证的直肠癌患者;但CT评价直肠系膜筋膜状态的价值有限,尤其是低位直肠癌。
(2)MRI。
①推荐MRI作为直肠癌常规检查项目。对于局部进展期直肠癌患者,需在新辅助治疗前后分别行基线和术前MRI检查,以评价新辅助治疗的效果。如无禁忌证,建议直肠癌行MRI扫描前肌注山莨菪碱抑制肠蠕动;建议行非抑脂、小视野轴位高分辨T2WI成像;推荐行磁共振弥散加权成像,尤其是新辅助治疗后的直肠癌患者;对于有MRI禁忌证的患者,可行CT增强扫描。
②临床或超声、CT检查怀疑肝转移时,推荐行肝脏MRI增强成像(建议结合肝细胞特异性对比剂钆塞酸二钠)。
(3)超声影像学检查:推荐直肠腔内超声用于早期直肠癌(T2期及以下)分期诊断。
(4)X线检查:推荐气钡双重X线造影作为诊断结直肠癌的方法,但不能用于结直肠癌分期。疑有结肠梗阻的患者应谨慎选择。
(5)PET-CT:不推荐常规使用,但对于病情复杂、常规检查无法明确诊断的患者可作为有效的辅助检查手段。术前检查提示为Ⅲ期以上的结直肠癌,为了解有无远处转移,可推荐使用。
(6)排泄性尿路造影:不推荐术前常规检查,仅适用于肿瘤较大且可能侵及尿路的患者。
2.6.2 结肠癌临床关键问题的影像学评价
推荐行全腹+盆腔CT(平扫+增强)扫描,可以兼顾肿瘤本身及转移瘤好发部位肝脏。影像科医师需评价结肠癌TNM分期及有无壁外血管侵犯。其他远处转移瘤如肺转移瘤的筛查,推荐行胸部CT检查;PET-CT有助于筛查全身转移瘤。
2.6.3 直肠癌临床关键问题的影像学评价
(1)推荐直肠癌患者行盆腔MRI检查。需明确肿瘤的位置、TNM分期、直肠系膜筋膜状态、有无壁外血管侵犯。
(2)其他部位远处转移瘤的筛查,肺部推荐行胸部CT扫描;肝脏推荐行肝脏MRI增强成像、CT增强扫描或超声造影检查,如条件允许建议首选肝脏MRI增强成像;全身筛查建议行PET-CT。
2.6.4 推荐使用直肠癌MRI结构式报告,模板请参见附表2。
2.6.5 可使用结肠癌CT结构式报告,模板请参见附表3。
2.6.6 对于腹部检查考虑肝转移的病例,可使用结直肠癌肝转移瘤CT及MRI结构式报告,模板请参见附表4,5。
2.7 组织病理学检查
活检病理学报告是结直肠癌的治疗依据。活检诊断为浸润性癌的病例进行规范性结直肠癌治疗。因取材的限制,活检病理学检查不能确定有无黏膜下层浸润,诊断为高级别上皮内瘤变的病例,建议临床医师综合其他临床信息包括内镜或影像学检查评估的肿瘤大小、侵犯深度、是否可疑淋巴结转移等,确定治疗方案。低位直肠肿瘤可能涉及保肛决策时,建议病理科医师在报告中备注说明活检组织是否达到"癌变"程度。推荐对临床确诊为复发或转移性结直肠癌患者进行KRAS、NRAS基因突变检测,以指导肿瘤靶向治疗。BRAF V600E突变状态的评估应在RAS检测时同步进行,以对预后进行分层,指导临床治疗。推荐对所有结直肠癌患者进行错配修复蛋白表达或微卫星不稳定检测,用于遗传性非息肉病性结直肠癌筛查、预后分层及指导免疫治疗等。MLH1缺失的错配修复蛋白缺陷型肿瘤应行BRAF V600E突变分子和(或)MLH1甲基化检测,以评估发生遗传性非息肉病性结直肠癌的风险。结直肠癌抗人表皮生长因子受体2治疗的临床研究获得了可喜的成果,但目前尚无规范的检测判读标准,有条件的医疗中心可适当开展相关工作。
2.8 开腹或腹腔镜探查术
以下情况,建议行开腹或腹腔镜探查术。
(1)经过各种诊断手段尚不能明确诊断且高度怀疑结直肠肿瘤。
(2)出现肠梗阻,保守治疗无效。
(3)可疑出现肠穿孔。
(4)保守治疗无效的下消化道大出血。
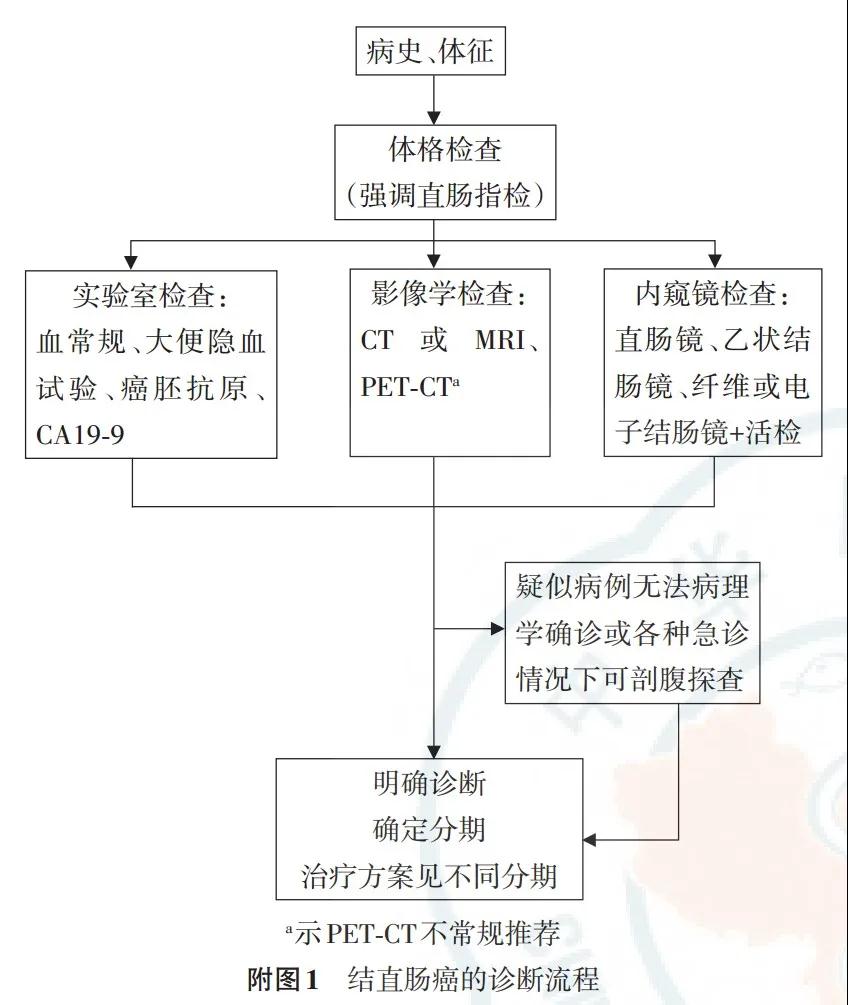
2.9 结直肠癌的诊断步骤
结直肠癌诊断步骤参见附图1。诊断结束后推荐行cTNM分期(附录)。
三、标本取材与病理学评估
3.1 标本固定标准
(1)固定液:推荐使用10%中性缓冲甲醛水溶液,避免使用含有重金属的固定液。
(2)固定液量:必须大于或等于所固定标本体积的5倍。
(3)固定温度:正常室温。
(4)固定时间:标本应尽快剖开固定,离体到开始固定的时间不宜超过30 min。手术标本必须规范化剖开固定,建议由病理科医师进行。内镜下切除腺瘤或活检标本:推荐6~48 h;手术标本:12~48 h。
3.2 取材要求
3.2.1 活检标本
(1)核对临床送检标本数量,送检活检标本必须全部取材。
(2)将标本包于纱布或柔软的透水纸中以免丢失。
(3)每个蜡块内包含不超过5粒活检标本,并依据组织大小适当调整。
3.2.2 内镜切除标本
(1)标本固定建议由临床医师规范化处理:活检标本离体后,应由内镜医师及时将活检黏膜组织基底面黏附于滤纸上,立即浸入固定液中固定。内镜下黏膜切除标本离体后,内镜医师展开标本,黏膜面向上,使用大头针固定于软木板或泡沫板,标示口侧缘和肛侧缘,翻转令黏膜面朝下放入固定液中。息肉切除标本,有蒂息肉可直接放入固定液中,无蒂息肉用墨汁标记好切缘后放入固定液中。
(2)建议记录标本和肿瘤的大小、各方向距切缘的距离。
(3)息肉切除标本的取材:首先明确息肉的切缘、有无蒂部及蒂部的直径。建议用墨汁标涂蒂部切缘(有蒂)及烧灼切缘(无蒂)。取材时要考虑到能够客观正确地评价切缘和有蒂型息肉蒂部的浸润情况。
建议按如下方式取材:无蒂息肉以切缘基底部为中心向左、右两侧全部取材。有蒂息肉当蒂切缘最大径>2 mm时,略偏离蒂切缘中心处垂直于蒂切缘平面切开标本,再平行此切面,间隔2~3 mm将标本全部取材;蒂切缘最大径≤2 mm时,垂直于蒂切缘平面间隔2~3 mm将全部标本取材,将蒂部作为一个单独的蜡块(图1)。推荐按同一包埋方向全部取材。记录组织块对应的方位。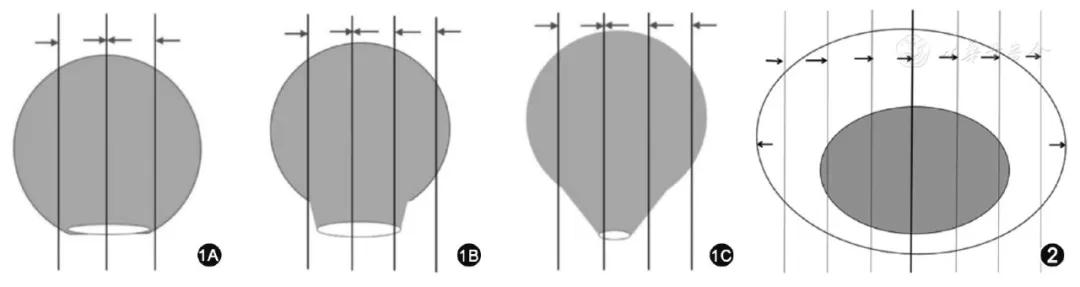
图1 结直肠癌内镜切除标本取材方法示意图(箭头方向示推荐包埋方向):1A示无蒂息肉以切缘基底部为中心平行切开,向左、右两侧全部取材;1B示蒂切除最大径>2 mm的有蒂息肉垂直于蒂切缘平面,间隔2~3 mm将标本全部取材;1C示蒂切除最大径≤2 mm的有蒂息肉垂直于蒂切缘平面,间隔2~3 mm将全部标本取材,将蒂部作为一个单独的蜡块 图2 内镜下黏膜切除术和黏膜剥离术标本取材示意图(箭头方向示推荐包埋方向):间隔2~3 mm平行切开标本,全部取材并按同一方向包埋
(4)内镜下黏膜切除术和黏膜剥离术标本的取材:由于肿物距切缘一般较近,切缘的评估尤其重要。建议涂以不同的颜料标记基底及侧切缘,以便在观察时能够对切缘做出定位,并评价肿瘤切缘情况。间隔2~3 mm平行切开标本(图2),如临床特别标记可适当调整,分成大小适宜的组织块,应全部取材并按同一方向包埋。
3.2.3 手术切除标本
(1)大体检查与记录:描述并记录肠管及肿瘤的大体特征,肿瘤与两侧切缘及放射状(环周)切缘的距离。推荐采用墨汁标记肿瘤对应的浆膜面及环周切缘,以准确评估肿瘤浸润深度及距切缘距离。淋巴结取材应按淋巴引流方向进行分组。建议临床医师将淋巴结分组送检(离体后病理科医师无法区分淋巴结分组)。
(2)取材。
①沿肠壁长轴剪开肠管、垂直于肠壁切取肿瘤标本,肿瘤组织充分取材,视肿瘤大小、浸润深度,于不同质地、颜色的区域分别取材,肿瘤浸润最深处至少取1块全层厚度肿瘤及肠壁组织,以判断肿瘤侵犯的最深层次。仔细观察浆膜受累情况,当肿瘤临近或侵犯浆膜时,于可疑侵犯浆膜的区域取材,以便镜下准确判断浆膜受累情况。切取能够显示肿瘤与邻近黏膜关系的组织。
②切取远侧、近侧手术切缘。推荐切取系膜及环周切缘,对于可疑系膜及环周切缘阳性的病例,建议于手术医师用墨汁标记的部分切取。建议尽量对不同切缘区分标记。
③切除标本如包含回盲部或肛管、肛门,应当于回盲瓣、齿状线、肛缘切缘取材。如肿瘤累及上述部位,应切除充分显示病变程度的组织块。常规取材阑尾。
④行中低位直肠癌根治术时需要完整切除直肠系膜,推荐病理科医师对手术标本进行系统检查及评价,包括系膜的完整性、环周切缘是否有肿瘤侵犯,病理学检查是评价直肠系膜完整性最直观的方法。
⑤包埋所有检出的淋巴结,较大淋巴结应剖开包埋,未经新辅助治疗的根治术标本应至少检出12枚淋巴结。
⑥新辅助治疗后的直肠癌手术标本,需仔细观察原肿瘤部位的改变并进行记录。如仍有较明显肿瘤,按常规方法进行取材。如肿瘤较小或肉眼无明显肿瘤,需根据治疗前肠镜等描述将原肿瘤所在范围全部取材。
(3)推荐取材组织块体积:小于或等于2.0 cm×1.5 cm×0.3 cm。
3.3 取材后标本处理原则和保留时限
(1)剩余标本的保存:取材剩余组织保存在标准固定液中,并始终保持充分的固定液量和甲醛浓度,避免标本干枯或因固定液量不足或甲醛浓度降低而发生组织腐变;以备根据镜下观察诊断需求而随时补充取材,或以备在病理学诊断报告签发后接到临床反馈信息时复查大体标本或补充取材。
(2)剩余标本处理的时限:建议在病理学诊断报告签发2周后,未接到临床反馈信息,未发生因外院会诊意见分歧而要求复审等情形后,由医疗中心自行处理。
(3)有条件的医疗中心最好低温保存新鲜组织,以备进一步研究使用。
3.4 病理学类型
3.4.1 早期(pT1期)结直肠癌
癌细胞穿透结直肠黏膜肌层浸润至黏膜下层,但未累及固有肌层,为早期结直肠癌(pT1期)。上皮重度异型增生及没有穿透黏膜肌层的癌称为高级别上皮内瘤变,包括局限于黏膜层、但有固有膜浸润的黏膜内癌。
如为内镜下或经肛的局部切除标本,建议对早期结直肠癌的黏膜下层浸润深度进行测量并分级。扁平病变当黏膜下层浸润深度≤1 000 μm时,为黏膜下层浅层浸润,是内镜治疗的适应证;当黏膜下层浸润深度>1 000 μm时,为黏膜下层深层浸润,需结合其他因素和临床情况考虑是否行外科手术扩大切除范围。黏膜肌层可以明确时,浸润深度为从黏膜肌层下缘至浸润最深处的距离,当黏膜肌层完全消失时,黏膜下层浸润深度从表面开始测量。有蒂病变分为两种情况,当黏膜肌层呈分支状生长时,以两侧肿瘤和非肿瘤交界点之间的连线为基线,基线以上的浸润视为头浸润,是内镜治疗的适应证;基线以下的浸润视为蒂浸润,相当于黏膜下层深层浸润,处理原则同上。当有蒂病变的黏膜肌层可以定位或不是呈分支状生长时,按扁平病变测量浸润深度。
3.4.2 进展期结直肠癌的大体类型
(1)隆起型。凡肿瘤的主体向肠腔内突出者,均属本型。
(2)溃疡型。肿瘤形成深达或贯穿肌层之溃疡者均属此型。
(3)浸润型。肿瘤向肠壁各层弥漫浸润,使局部肠壁增厚,但表面常无明显溃疡或隆起。
3.4.3 组织学类型
(1)腺癌,非特殊型。
(2)腺癌,特殊型,包括黏液腺癌、印戒细胞癌、锯齿状腺癌、微乳头状癌、髓样癌、筛状粉刺型腺癌。
(3)腺鳞癌。
(4)鳞状细胞癌。
(5)梭形细胞癌或肉瘤样癌。(6)未分化癌。
(7)其他特殊类型。
(8)癌,不能确定类型。
3.4.4 组织学分级
结直肠腺癌(非特殊型)组织学分级标准见表1。
表1 结直肠腺癌(非特殊型)组织学分级标准(依据2010版WHO标准)
3.5 病理学报告内容
3.5.1 活检标本的病理学报告内容和要求
(1)患者基本信息及送检信息。
(2)如有上皮内瘤变(异型增生),报告分级。对于低位直肠肿瘤诊断为高级别上皮内瘤变时,因可能涉及治疗方案的决策,建议病理科医师在报告中备注说明活检组织有无达到"癌变"程度。
(3)如为浸润性癌,区分组织学类型。
(4)确定为结直肠癌时,推荐检测错配修复蛋白(MLH1、PMS2、MSH2、MSH6)表达情况。确定为无法手术切除的结直肠癌时,建议检测KRAS、NRAS、BRAF基因突变情况及其他相关基因状态。
临床医师应当了解活检标本的局限性,活检病理学检查不能完全确定有无黏膜下层浸润时,诊断为高级别上皮内瘤变,此时肿瘤主体可能为浸润性癌。
3.5.2 内镜切除标本的病理学报告内容和要求
(1)患者基本信息及送检信息。
(2)标本大小、肿瘤大小。
(3)上皮内瘤变(异型增生)的分级。
(4)如为穿透黏膜肌层浸润到黏膜下的浸润性癌,报告癌组织的组织学分型、分级、黏膜下层浸润深度、脉管侵犯情况、神经侵犯情况、水平切缘及垂直切缘情况,推荐检测错配修复蛋白(MLH1、PMS2、MSH2、MSH6)表达情况,建议报告肿瘤出芽分级。
如肿瘤具有3或4级分化、黏膜下深层浸润、脉管侵犯、基底切缘阳性(肿瘤距电灼切缘<1 mm,水平切缘可见腺瘤或低级别异型增生时,切缘认定为阴性,但需标注)等高危因素,临床需考虑再行外科手术。
3.5.3 手术标本的病理学报告内容和要求
(1)患者基本信息及送检信息。
(2)大体情况:肿瘤大小、大体类型、肉眼所见浸润深度、有无穿孔、肿瘤距两侧切缘的距离。
(3)肿瘤分化程度(肿瘤分型、分级)。
(4)肿瘤浸润深度(pT分期)(pT分期或ypT分期是根据有活力的肿瘤细胞决定的,经过新辅助治疗的标本内无细胞的黏液湖不认为是肿瘤残留)。
(5)对于Ⅰ期和Ⅱ期结直肠癌,肿瘤出芽为预后不良因素,建议对无淋巴结转移的结直肠癌病例报告肿瘤出芽分级。肿瘤出芽是位于肿瘤浸润前缘,5个细胞以下的肿瘤细胞簇。报告20倍视野下,肿瘤出芽最密集的区域("热点区")的出芽数目分级,分级标准见表2。
表2 结直肠癌病理学报告肿瘤出芽分级标准
(6)检出淋巴结数目、阳性淋巴结数目及淋巴结外肿瘤结节(pN分期),后者指肠周脂肪组织内与原发肿瘤不相连的实性癌结节,镜下可见癌细胞沉积但未见残留淋巴结结构。无淋巴结转移、有癌结节时,报告为pN1c期,并需报告癌结节数目;有淋巴结转移时,依照阳性淋巴结数目进行pN分期,无需考虑癌结节,但病理学报告中同样需报告癌结节数目。
(7)近端切缘、远端切缘的状况。
(8)推荐报告系膜及环周切缘的状况(如果肿瘤距切缘很近,应当在显微镜下测量并报告肿瘤与切缘的距离,肿瘤距切缘1 mm以内报切缘阳性)。
(9)肿瘤退缩分级,用以评估肿瘤新辅助治疗疗效(表3)。
表3 结直肠癌病理学报告肿瘤退缩分级标准
(10)脉管侵犯情况(以V代表血管,V1为镜下血管浸润,V2为肉眼血管浸润,L代表淋巴管)。建议尽量区分血管与淋巴管浸润。
(11)神经束侵犯。
(12)错配修复蛋白(MLH1、PMS2、MSH2、MSH6)表达情况。建议根据免疫组化检测结果选择检测错配修复蛋白基因的突变状态和甲基化状态。
(13)确定为复发或转移性结直肠癌时,推荐检测KRAS、NRAS、BRAF基因状态。如无手术切除标本可从活检标本中测定。
完整的病理学报告的前提是临床医师填写详细的病理学诊断申请单,详细描述手术所见及相关临床辅助检查结果并清楚标记淋巴结。临床医师与病理科医师的相互交流、信任和配合是建立正确分期和指导临床治疗的基础。内镜切除标本与手术切除标本结构式报告模板请参见附表6,7。
四、外科治疗
4.1 结肠癌的外科治疗规范
4.1.1 结肠癌的手术治疗原则
(1)全面探查,由远及近。必须探查记录肝脏、胃肠道、子宫及附件、盆底腹膜,以及相关肠系膜和主要血管淋巴结和肿瘤邻近器##官的情况。
(2)推荐常规切除足够的肠管,清扫区域淋巴结,并进行整块切除,建议常规清扫两站以上淋巴结。
(3)推荐锐性分离技术。
(4)推荐遵循无瘤手术原则。
(5)对已失去根治性手术机会的肿瘤,如果患者无出血、梗阻、穿孔症状或肿瘤压迫周围器##官引起的相关症状,则根据多学科讨论确定是否需要切除原发灶。
(6)结肠新生物临床诊断高度怀疑恶性肿瘤及活检报告为高级别上皮内瘤变时,如患者可耐受手术,建议行手术探查。
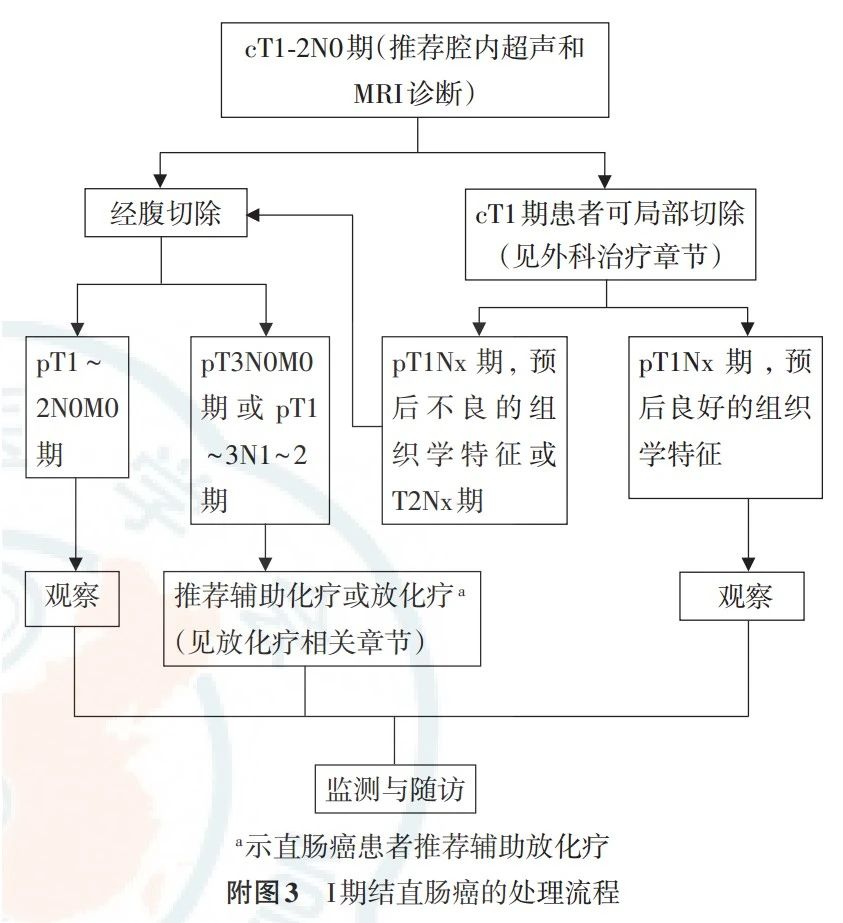
4.1.2 cT1N0M0期结肠癌
建议采用内镜下切除、局部切除或肠段切除术。侵入黏膜下层的浅浸润癌(SM1期),可考虑行内镜下切除。决定行内镜下切除前,需要仔细评估肿瘤大小、预测浸润深度,肿瘤分化程度等相关信息。术前内镜超声检查属T1期或局部切除术后病理学证实为T1期,如果肿瘤切除完整、切缘(包括基底)阴性且具有预后良好的组织学特征(如分化程度良好、无脉管浸润),则无论是广基还是带蒂,不推荐再行手术切除。如果具有预后不良的组织学特征,或者非完整切除,标本破碎切缘无法评价,推荐追加肠段切除术加区域淋巴结清扫。
如行内镜下切除或局部切除必须满足如下要求。
(1)肿瘤最大径<3 cm。
(2)肿瘤侵犯肠周<30%。
(3)切缘距离肿瘤>3 mm。
(4)肿瘤活动,不固定。
(5)仅适用于T1期肿瘤。
(6)高-中分化。
(7)治疗前影像学检查无淋巴结转移征象。
局部切除标本必须由手术医师展平、固定,标记方位后送病理学检查。
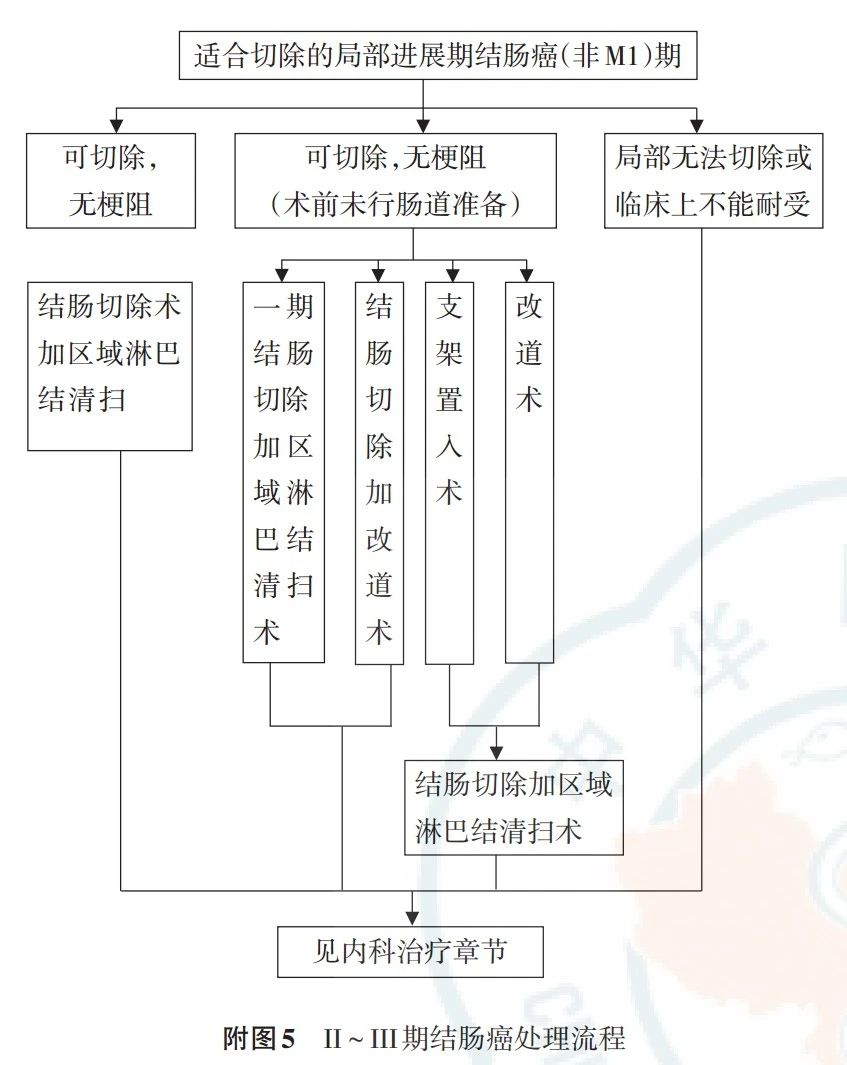
4.1.3 T2~4N0~2M0期结肠癌
(1)首选的手术方式是相应结肠肠段的切除加区域淋巴结清扫。区域淋巴结清扫必须包括肠旁、中间和系膜根部淋巴结。建议标示系膜根部淋巴结并送病理学检查;如果怀疑清扫范围以外的淋巴结、结节有转移推荐完整切除,无法切除者视为姑息切除。
(2)家族性腺瘤性息肉病如已发生癌变,根据癌变部位,行全结直肠切除加回肠储袋肛管吻合术、全结直肠切除加回肠直肠端端吻合术或全结直肠切除加回肠造口术。尚未发生癌变者可根据病情选择全结直肠切除或肠段切除。遗传性非息肉病性结直肠癌患者应在与患者充分沟通的基础上,选择全结直肠切除或肠段切除结合肠镜随访。
(3)肿瘤侵犯周围组织器##官建议联合器##官整块切除。术前影像学报告为T4期的结肠癌,在多学科讨论的前提下,可行新辅助化疗后再施行结肠切除术。
(4)行腹腔镜辅助的结肠切除术建议由有腹腔镜经验的外科医师根据情况酌情实施。
(5)对于已经引起梗阻的可切除结肠癌,推荐行一期切除吻合,或一期肿瘤切除近端造口远端闭合,或造口术后二期切除,或支架植入术后限期切除。如果肿瘤局部晚期不能切除,建议给予包括手术在内的姑息性治疗,如近端造口术、短路手术、支架植入术等。
4.2 直肠癌的外科治疗
直肠癌手术的腹腔探查处理原则同结肠癌。
4.2.1 cT1N0M0期直肠癌
治疗处理原则同早期结肠癌。如经肛门切除(非经腔镜或内镜下)必须满足如下要求。
(1)肿瘤最大径<3 cm。
(2)肿瘤侵犯肠周<30%。
(3)切缘距离肿瘤>3 mm。
(4)肿瘤活动,不固定。
(5)距肛缘<8 cm。
(6)仅适用于T1期肿瘤。
(7)无血管淋巴管浸润或神经浸润。
(8)高-中分化。
(9)治疗前影像学检查无淋巴结转移征象。
局部切除标本必须由手术医师展平、固定,标记方位后送病理检查。
4.2.2 cT2~4N0~2M0期直肠癌
推荐行根治性手术治疗。中上段直肠癌推荐行低位前切除术,低位直肠癌推荐行腹会阴联合切除术或慎重选择保肛手术。中下段直肠癌必须遵循直肠癌全系膜切除术原则,尽可能锐性游离直肠系膜。尽量保证环周切缘阴性,对可疑环周切缘阳性者,应追加后续治疗。肠壁远切缘距离肿瘤1~2 cm,直肠系膜远切缘距离肿瘤≥5 cm或切除全直肠系膜,必要时可行术中冰冻病理学检查,确定切缘有无肿瘤细胞残留。在根治肿瘤的前提下,尽可能保留肛门括约肌功能、排尿和性功能。治疗原则如下。
(1)切除原发肿瘤,保证足够切缘,远切缘至少距肿瘤远端2 cm。下段直肠癌(距离肛门<5 cm)远切缘距肿瘤1~2 cm者,建议行术中冰冻病理学检查证实切缘阴性。直肠系膜远切缘距肿瘤下缘≥5 cm或切除全直肠系膜。
(2)切除直肠系膜内淋巴脂肪组织及可疑阳性的侧方淋巴结。
(3)尽可能保留盆腔自主神经。
(4)术前影像学检查提示cT3~4期和(或)N+的局部进展期中下段直肠癌,建议行新辅助放化疗或新辅助化疗,新辅助放化疗与手术的间隔时间见放化疗章节。
(5)肿瘤侵犯周围器##官者争取联合器##官切除。
(6)合并肠梗阻的直肠新生物,临床高度怀疑恶性,而无病理学诊断,不涉及保肛问题并可耐受手术的患者,建议剖腹探查。
(7)对于已经引起肠梗阻的可切除直肠癌,推荐行一期切除吻合,或Hartmann手术,或造瘘术后二期切除,或支架植入解除梗阻后限期切除。一期切除吻合前推荐行术中肠道灌洗。如估计吻合口瘘发生风险较高,建议行Hartmann手术或一期切除吻合及预防性肠造口。
(8)如果肿瘤局部晚期不能切除或患者不能耐受手术,推荐给予姑息性治疗,包括选用放疗处理不可控制的出血和疼痛,近端双腔造口术、支架植入术处理肠梗阻,以及支持治疗。
(9)术中如有明确肿瘤残留,建议放置金属夹作为后续放疗的标记。
(10)腹腔镜辅助的直肠癌根治术建议由有腹腔镜手术经验的外科医师根据具体情况实施。
五、内科治疗
内科药物治疗的总原则:必须明确治疗目的,确定属于新辅助治疗、辅助治疗还是姑息治疗;必须在全身治疗前完善影像学基线评估,同时推荐完善相关基因检测。推荐对临床确诊的复发或转移性结直肠癌患者进行KRAS、NRAS基因突变检测,以指导肿瘤靶向治疗。BRAF V600E突变状态的评估应在RAS检测时同步进行,以对预后进行分层,指导临床治疗。推荐对所有结直肠癌患者进行错配修复蛋白表达或微卫星不稳定检测,用于遗传性非息肉病性结直肠癌筛查、预后分层及指导免疫治疗等。MLH1缺失的错配修复蛋白缺陷型肿瘤应行BRAF V600E突变分子和(或)MLH1甲基化检测,以评估发生遗传性非息肉病性结直肠癌的风险。一些结直肠癌抗人表皮生长因子受体2治疗临床研究获得了可喜的成果,但目前尚无规范的检测判读标准,有条件的医疗中心可适当开展相关工作。在治疗过程中必须及时评价疗效和不良反应,并在多学科指导下根据患者病情及体力评分适时地进行治疗目标、药物种类及剂量的调整。重视改善患者生活质量及处理合并症,包括疼痛、营养、精神心理等。
5.1 结直肠癌的新辅助治疗
5.1.1 直肠癌的新辅助治疗
新辅助治疗目的是提高手术切除率,提高保肛率,延长患者无病生存时间。推荐新辅助放化疗仅适用于距肛门<12 cm的直肠癌。
(1)推荐以氟尿嘧啶类药物为基础的新辅助放化疗。
(2)T1~2N0M0期或有放化疗禁忌证的患者推荐直接手术,不推荐新辅助治疗。
(3)T3期和(或)N+的可切除直肠癌患者,原则是推荐新辅助放化疗(具体放疗适应证参见直肠癌放疗章节);也可考虑在多学科讨论后行单纯新辅助化疗,后根据疗效评估决定是否联合放疗。
(4)T4期或局部晚期不可切除的直肠癌患者,必须行新辅助放化疗。治疗后必须重新评价,多学科讨论是否可行手术。
新辅助放化疗中,化疗方案推荐首选卡培他滨单药或持续灌注氟尿嘧啶或氟尿嘧啶+亚叶酸钙,在长程放疗期间同步进行化疗。放疗方案请参见放疗章节。
(5)对于不适合放疗的患者,推荐通过多学科讨论决定是否行单纯的新辅助化疗。
5.1.2 T4b期结肠癌新辅助治疗
(1)对于初始局部不可切除的T4b期结肠癌,推荐化疗方案或化疗联合靶向治疗方案(具体方案参见结直肠癌肝转移新辅助治疗)。必要时,通过多学科讨论决定是否增加局部放疗。
(2)对于初始局部可切除的T4b期结肠癌,推荐通过多学科讨论决定是否行新辅助化疗或直接手术治疗。
5.1.3 结直肠癌肝和(或)肺转移新辅助治疗
结直肠癌患者合并肝转移和(或)肺转移,转移灶为可切除或潜在可切除,具体参见相关章节。如果多学科讨论推荐新辅助化疗或化疗联合靶向药物治疗,可选用西妥昔单抗(推荐用于KRAS、NRAS、BRAF基因野生型患者),或联合贝伐珠单抗。化疗方案推荐CapeOx(卡培他滨+奥沙利铂),或者FOLFOX(奥沙利铂+氟尿嘧啶+醛氢叶酸),或者FOLFIRI(伊立替康+氟尿嘧啶+醛氢叶酸),或者FOLFOXIRI(奥沙利铂+伊立替康+氟尿嘧啶+醛氢叶酸)。建议治疗时限为2~3个月。
治疗后必须重新评价,并考虑是否可行局部毁损性治疗,包括手术、射频和立体定向放疗。
5.2 结直肠癌辅助治疗
辅助治疗应根据肿瘤原发部位、病理学分期、分子指标及术后恢复状况决定。推荐术后4周左右开始辅助化疗(体质差者适当推迟),化疗时限3~6个月。治疗期间应根据患者体力情况、药物毒性、术后T和N分期及患者意愿,酌情调整药物剂量和(或)缩短化疗周期。
(1)Ⅰ期(T1~2N0M0)结直肠癌不推荐辅助治疗。
(2)Ⅱ期结肠癌的辅助化疗,应确认有无以下高危因素:组织学分化差(3~4级)且为错配修复正常或微卫星稳定、T4期、血管淋巴管浸润、术前肠梗阻或肠穿孔、标本检出淋巴结不足(少于12枚)、神经侵犯、切缘阳性或不能确定。
①无高危因素者,建议随访观察,或单药氟尿嘧啶类药物化疗。
②有高危因素者,建议辅助化疗。化疗方案推荐选用以奥沙利铂为基础的CapeOx或FOLFOX方案,或者单药氟尿嘧啶+亚叶酸钙、卡培他滨,治疗时间3~6个月。
③如肿瘤组织检测为错配修复缺陷或高水平微卫星不稳定,不建议辅助化疗。
(3)Ⅱ期直肠癌辅助放疗参见放疗章节。
(4)Ⅲ期结直肠癌推荐辅助化疗。化疗方案推荐选用CapeOx、FOLFOX方案或单药卡培他滨、氟尿嘧啶+亚叶酸钙方案。如为低危患者(T1~3N1期)也可考虑3个月的CapeOx方案。
(5)直肠癌辅助放化疗:T3~4期或N1~2期距肛缘<12 cm的直肠癌,推荐新辅助放化疗;如未行新辅助放疗,可根据术后病理学检查结果决定是否行辅助放化疗。化疗推荐以氟尿嘧啶类药物为基础的方案,放疗方案参见放疗章节。
(6)目前不推荐在辅助化疗中使用伊立替康、替吉奥、雷替曲塞及靶向药物。
5.3 复发或转移性结直肠癌全身系统治疗
目前,治疗晚期或转移性结直肠癌使用的化疗药物包括氟尿嘧啶+亚叶酸钙、伊立替康、奥沙利铂、卡培他滨、曲氟尿苷替匹嘧啶和雷替曲塞。靶向药物包括西妥昔单抗(推荐用于KRAS、NRAS、BRAF基因野生型患者)、贝伐珠单抗、瑞格非尼和呋喹替尼。
(1)在治疗前推荐检测肿瘤KRAS、NRAS、BRAF基因及微卫星状态。
(2)联合化疗应作为能耐受化疗的转移性结直肠癌患者的一、二线治疗。推荐以下化疗方案:FOLFOX或FOLFIRI,或联合西妥昔单抗(推荐用于KRAS、NRAS、BRAF基因野生型患者),CapeOx、FOLFOX或FOLFIRI,或联合贝伐珠单抗。对于肿瘤负荷大、预后差或需要转化治疗的患者,如一般情况允许,也可考虑FOLFOXIRI或联合贝伐珠单抗作为一线治疗。对于KRAS、NRAS、BRAF基因野生型需转化治疗的患者,也可考虑FOLFOXIRI联合西妥昔单抗。
(3)右半结肠癌(病灶位于回盲部至结肠脾曲)患者预后明显劣于左半结肠癌和直肠癌(病灶位于结肠脾曲至直肠)。对于KRAS、NRAS、BRAF基因野生型患者,右半结肠癌一线治疗中抗血管内皮细胞生长因子受体单抗(贝伐珠单抗)联合化疗的疗效优于抗表皮生长因子受体单抗(西妥昔单抗)联合化疗,而在左半结肠癌和直肠癌中后者的疗效优于前者。
(4)三线及以上治疗患者推荐试用靶向药物或参加正在开展的临床试验,也可考虑曲氟尿苷替匹嘧啶。瑞戈非尼可根据患者病情及身体情况,调整第一周期治疗初始剂量。对在一、二线治疗中没有选用靶向药物的患者也可考虑西妥昔单抗,或联合伊立替康治疗(推荐用于KRAS、NRAS、BRAF基因野生型患者)。
(5)一线治疗选择奥沙利铂的患者,如二线治疗方案为化疗或联合贝伐珠单抗时,化疗方案推荐FOLFIRI或改良的伊立替康+卡培他滨。不能耐受联合化疗的患者,推荐氟尿嘧啶+亚叶酸钙方案或卡培他滨单药,或联合靶向药物。不适合氟尿嘧啶+亚叶酸钙方案的晚期结直肠癌患者可考虑雷替曲塞单药治疗。
(6)姑息治疗4~6个月后疾病稳定但仍无R0切除机会的患者,可考虑进入维持治疗(如采用毒性较低的氟尿嘧啶+亚叶酸钙、卡培他滨单药,或联合靶向治疗,或暂停全身系统治疗),以降低联合化疗的毒性。
(7)对于BRAF V600E突变患者,如果一般状况较好,可考虑FOLFOXIRI联合贝伐珠单抗的一线治疗。
(8)对于错配修复缺陷或高水平微卫星不稳定患者,根据其病情及意愿,通过多学科讨论可考虑行免疫检查点抑制剂治疗。
(9)晚期患者如一般状况或器##官功能状态很差,推荐最佳支持治疗。
(10)如果转移局限于肝和(或)肺,参见肝(肺)转移治疗章节。
(11)结直肠癌术后局部复发者,推荐进行多学科评估,判定能否有机会行再次切除、放疗或消融等局部治疗,以达到无肿瘤证据状态。如仅适于全身系统治疗,则采用上述晚期患者药物治疗原则。
5.4 其他治疗
晚期患者在上述常规治疗不适用的前提下,可以选择局部治疗,如介入治疗、瘤体内注射、物理治疗或中医中药治疗。
5.5 最佳支持治疗
最佳支持治疗应贯穿于患者的治疗全过程,建议多学科综合治疗。最佳支持治疗推荐涵盖以下方面。
(1)疼痛管理:准确完善疼痛评估,综合合理治疗疼痛,推荐按照疼痛三阶梯治疗原则进行,积极预防处理止痛药物不良反应。同时关注病因治疗。重视患者及家属疼痛教育和社会精神心理支持。加强沟通随访。
(2)营养支持:建议常规评估营养状态,给予适当的营养支持,倡导肠内营养支持。
(3)精神心理干预:建议有条件的地区由癌症心理专业医师进行心理干预和必要的抗精神病药物干预。
5.6 临床研究及新进展
临床试验有可能在现有标准治疗基础上给患者带来更多获益。鉴于目前标准药物治疗疗效仍存在不少局限,建议鼓励患者在自愿的前提下参加与其病情相符的临床试验。
对于有特殊基因变异的晚期结直肠癌(如BRAF基因突变,人表皮生长因子受体2扩增,KRAS、BRCA基因致病突变,NTRK基因融合等),国外有早期小样本研究结果显示其对应的靶向治疗具有一定疗效。首先推荐此类患者参加与其病情适宜的临床研究,也可考虑在有经验的肿瘤内科医师指导下尝试特殊靶点的治疗。对于标准治疗失败的患者,可考虑在有资质的基因检测机构行二代测序以寻找其适宜参与的临床研究或药物治疗。目前,对于微卫星稳定或错配修复正常的患者,免疫检查点抑制剂单药治疗无明显疗效。应根据患者病情及意愿,在其充分知情的前提下,鼓励其参加免疫检查点抑制剂联合其他药物的临床研究。
六、放疗
6.1 结直肠癌放疗适应证
直肠癌放疗或放化疗的主要目的为新辅助或辅助治疗、根治性治疗、转化性放疗和姑息治疗。
新辅助放疗的适应证主要是Ⅱ~Ⅲ期中低位直肠癌(肿瘤距肛门<12 cm)。长程同步放化疗结束后,推荐间隔5~12周接受根治性手术;短程放疗联合即刻根治性手术(在放疗完成后1周手术)推荐用于MRI或超声内镜诊断的可手术切除的T3期直肠癌;短程放疗联合延迟根治性手术,且在等待期间加入新辅助化疗的模式,推荐用于具有高危复发因素的Ⅱ~Ⅲ期直肠癌。辅助放疗主要推荐用于未行新辅助放疗,术后病理学分期为Ⅱ~Ⅲ期且局部复发高危的直肠癌患者。不具备放疗设备和条件的医疗中心,对需要新辅助或辅助放疗的患者,应推荐至有放疗设备和条件的医疗中心接受放疗。
低位直肠癌有强烈保肛意愿的患者,可建议先行放化疗。如果肿瘤对放化疗敏感,达到临床完全缓解,可考虑等待观察的治疗策略;未达临床完全缓解,建议行根治性手术。对于发生复发或转移但具有根治机会的直肠癌患者,如直肠局部复发病灶切除困难,在之前未接受放疗的前提下,可考虑局部放疗使之转化为可切除病灶再行手术切除。直肠癌患者姑息放疗的适应证为肿瘤局部区域复发和(或)远处转移,或患者不能耐受手术,无法通过放疗和综合治疗达到治愈。结肠癌姑息切除手术后,留置标记,也可考虑辅助放疗。
6.1.1 Ⅰ期直肠癌放疗
Ⅰ期直肠癌局部切除术后,有高危因素者,推荐行根治性手术(高危因素详见外科治疗章节);如因各种原因无法进一步行根治性手术,建议辅助放疗。
6.1.2 Ⅱ~Ⅲ期直肠癌新辅助放化疗
临床诊断的Ⅱ~Ⅲ期直肠癌,局部检查首选直肠MRI(见第2部分);如果患者不能接受MRI检查,推荐行直肠腔内超声检查。推荐根据肿瘤位置并结合MRI提示的复发危险度进行分层治疗(表4)。推荐行新辅助放疗或新辅助同步放化疗。
表4 Ⅱ~Ⅲ期直肠癌新辅助放化疗分层治疗推荐
6.1.3 Ⅱ~Ⅲ期直肠癌辅助放化疗
未行新辅助放化疗且术后病理学诊断为Ⅱ~Ⅲ期直肠癌,根据全直肠系膜切除术手术治疗、环周切缘状态、肿瘤距肛缘距离等予以分层治疗推荐(表5)。
表5 Ⅱ~Ⅲ期直肠癌辅助放化疗分层治疗推荐
6.1.4 等待观察策略
对于保留肛门括约肌有困难的低位直肠癌(cT1N0、cT2N0、cT3~4或N+),如患者有强烈保肛意愿,建议行新辅助同步放化疗,如果放化疗后获得临床完全缓解可采取等待观察策略。临床完全缓解的评价时间建议为同步放化疗后8~12周,并且建议每1~2个月随访,持续1~2年。临床完全缓解强烈推荐的评价项目包括直肠指检、肠镜、直肠MRI、血癌胚抗原水平,所有项目均需达到临床完全缓解评判标准(表6)。
表6 直肠癌新辅助化疗后临床完全缓解评判标准
6.1.5 Ⅳ期直肠癌
对于转移灶可切除或潜在可切除的Ⅳ期直肠癌,建议化疗或联合原发灶放疗,或手术切除;如放疗,可在放疗后4周重新评估可切除性;转移灶必要时行立体定向放疗或姑息减症放疗。
6.1.6 局部区域复发直肠癌
局部区域复发患者,如既往未接受盆腔放疗,建议行新辅助同步放化疗,放化疗后重新评估,并争取手术切除;如既往接受过盆腔放疗,应谨慎评估二程放疗风险,建议多学科讨论决定治疗方案。
6.2 直肠癌放疗规范
根据医疗中心具有的放疗设备选择不同的放疗技术,推荐采用三维适形或调强放疗技术,相比二维放疗技术具有更好的剂量覆盖、均匀性、适形性,并降低临近危及器##官的受量,从而降低放疗相关不良反应发生率,增加患者对放疗的耐受性。推荐CT模拟定位,如无CT模拟定位,必须行常规模拟定位。如果行调强放疗,必须进行计划验证。局部加量可采用术中放疗、腔内照射或外照射技术。放射性粒子植入治疗不推荐常规应用。
6.2.1 三维及调强放疗定位
(1)定位前准备:推荐定位前1 h排空膀胱后饮水以使膀胱充盈。
(2)体位和体膜固定:可采用仰卧位或俯卧位,热塑体膜固定。推荐行直肠癌新辅助放疗或低位前切除术后辅助放疗者,为明确肛缘位置可在肛门口放置铅点标记;推荐直肠癌腹会阴联合切除术后的放疗患者,用细铅丝标记会阴部瘢痕。
(3)模拟CT:CT扫描的范围建议上界自L2~3水平,下界至股骨上中1/3段,层厚5 mm。建议患者在不过敏的前提下行静脉造影增强扫描,以清楚显示肿瘤和血管。接受新辅助放疗者,推荐有条件的医疗中心同时应用MRI定位。CT和MRI融合有助于明确肿瘤范围,以便更精确地进行靶区勾画。
6.2.2 照射范围及靶区定义
大体靶区指通过临床检查手段确定的大体肿瘤;临床靶区包括大体靶区,以及原发肿瘤高危复发区域和区域淋巴引流区,必须进行照射;计划靶区由临床靶区外扩形成,包括临床靶区本身,并涵盖照射中器##官运动和平时摆位等不确定因素。
(1)原发肿瘤高危复发区域包括肿瘤及瘤床、直肠系膜区和骶前区。放射野推荐包括肿瘤及瘤床,以及2~5 cm的安全边缘。
(2)区域淋巴引流区包括直肠系膜区、髂内血管淋巴引流区和闭孔血管淋巴结区。T4期肿瘤侵犯前方结构时可照射髂外血管淋巴引流区。
(3)有肿瘤和(或)残留者,全盆腔照射后局部缩野加量照射,同时需慎重考虑肠道受照射剂量。
(4)危及器##官定义:盆腔内的小肠、结肠、膀胱、双侧股骨头、男女外生殖器和女性会阴为直肠癌手术前后放疗区域内的危及器##官,建议勾画并给予照射剂量与体积的限定。
(5)盆腔复发病灶的放疗:既往无放疗病史,建议行复发肿瘤及高危复发区域放疗,可考虑肿瘤局部加量放疗。既往有放疗史,根据情况决定是否放疗。
(6)具体的靶区勾画与危及器##官定义,参考放疗专业书籍。
6.2.3 放疗剂量及分割模式
无论使用常规照射技术还是三维适形放疗或调强放疗等技术,都必须有明确的照射剂量定义方式。三维适形照射和调强放疗必须应用体积剂量定义方式,常规照射则应用等中心点的剂量定义模式。
(1)新辅助放疗分割模式:主要有两种。①短程放疗模式,推荐原发肿瘤和高危区域给予5 Gy×5次放疗。短程放疗分割模式不适于直肠系膜筋膜阳性或T4期直肠癌患者(即初始不能达到R0切除或无法切除的局部晚期直肠癌)。短程放疗+即刻全直肠系膜切除术的方法,短程放疗前必须经过多学科讨论,与外科医师充分沟通放疗与手术时间的衔接。②长程放化疗模式,推荐对原发肿瘤和高危区域照射肿瘤剂量45.0~50.4 Gy,每次1.8~2.0 Gy,共25~28次;放疗过程中同步给予氟尿嘧啶或卡培他滨单药化疗。长程放化疗模式适合于所有Ⅱ~Ⅲ期直肠癌患者,有利于肿瘤的充分退缩。③新辅助放疗如采用其他剂量分割方式,有效生物剂量必须≥30 Gy。
(2)辅助放化疗剂量:对于未行新辅助放疗的Ⅱ~Ⅲ期患者,推荐术后对瘤床和高危区域给予肿瘤剂量45.0~50.4 Gy,每次1.8~2.0 Gy,共25~28次;放疗过程中同步给予氟尿嘧啶或卡培他滨单药化疗。对于术后有肿瘤残留或切缘阳性者,建议行二次手术;如果不能行二次手术或患者拒绝二次手术,建议在全盆腔照射后局部缩野追加照射肿瘤剂量10~20 Gy,如肠管在靶区内不推荐同步加量的方式。必须考虑肠道受照射剂量,尤其是放射野内小肠和结肠的肿瘤剂量必须≤56 Gy。
6.2.4 新辅助放疗与手术间隔时间推荐
新辅助放疗与手术间隔时间根据新辅助放疗的疗程进行不同的推荐。短程放疗(5 Gy×5)后1周手术(短程放疗即刻手术模式),或者6~8周手术(短程放疗延迟手术模式)。
长程放化疗后建议5~12周手术。
6.3 直肠癌放化疗联合的原则
6.3.1 同步化疗的方案
(1)长程放疗期间同步化疗方案推荐氟尿嘧啶类单药,具体有以下3种。
①卡培他滨825 mg/m2,2次/d,5 d/周,建议放疗日口服。
②氟尿嘧啶225 mg·m-2·d-1,放疗期间持续静脉滴注,24 h/d,5~7 d/周。
③氟尿嘧啶400 mg·m-2·d-1+亚叶酸钙20 mg·m-2·d-1,在放疗第1、5周的第1~4天静脉注射。
(2)双药联合方案可能会增加肿瘤退缩概率,但证据级别较低,不建议临床研究以外使用。
(3)直肠癌新辅助同步放化疗不建议联合贝伐珠单抗、西妥昔单抗、帕尼单抗等靶向药物。
(4)短程放疗不建议同期应用化疗及靶向治疗药物。
6.3.2 同步放化疗或短程放疗与手术间隔期加入化疗的模式
局部晚期直肠癌,特别是治疗前评估直肠系膜筋膜阳性或T4b期或侧方淋巴结转移的患者,在长程同步放化疗或短程放疗之后,可根据多学科讨论意见,有计划地根据肿瘤退缩情况进行化疗,之后再进行手术,以增加肿瘤退缩的程度。化疗方案可采用FOLFOX、CapeOx或卡培他滨单药方案,建议间隔期化疗2~6个疗程。
6.3.3 术后辅助放化疗和辅助化疗的顺序
Ⅱ~Ⅲ期直肠癌根治术后,需要追加盆腔放疗者,推荐先行同步放化疗再行辅助化疗,或者先行1~2个周期辅助化疗、同步放化疗再行辅助化疗的夹心治疗模式。对于切缘阴性的pN2期患者,也可以考虑先行辅助化疗再行同步放化疗模式。
6.4 结直肠癌转移病灶的放疗
推荐多学科讨论共同制定最合理的治疗方案。—般根据以下几方面判断:(1)转移灶大小、个数、具体部位;(2)患者接受其他治疗的情况;(3)转移器##官如肝脏本身的功能状态;(4)其他部位肿瘤的控制情况。结直肠癌转移灶放疗的主要获益是减轻局部症状,对数目少或孤立的病灶起到根治作用。
七、肝转移的治疗
7.1 初始可达到根治性切除的结直肠癌肝转移
同时性肝转移是指结直肠癌确诊时发现的肝转移,而结直肠癌根治术后发生的肝转移称为异时性肝转移。推荐所有肝转移患者接受多学科协作治疗。
7.1.1 新辅助化疗
(1)结直肠癌确诊时合并初始可根治性切除的肝转移:在原发灶无出血、梗阻或穿孔,且肝转移灶有清除后复发高危因素时推荐新辅助化疗,化疗方案见内科治疗章节。
(2)结直肠癌根治术后发生的可根治性切除的肝转移:原发灶切除术后未接受过化疗,或化疗12个月以前已完成,且肝转移灶有清除后复发高危因素时可采用术前化疗,化疗方案见内科治疗章节;肝转移发现前12个月内接受过化疗的患者,可直接切除肝转移灶。
7.1.2 辅助化疗
肝转移灶清除后达到无疾病状态的患者推荐根据术前治疗情况及术后病理学结果通过多学科讨论决定是否行辅助化疗。
7.1.3 局部治疗
(1)肝转移灶手术适应证。
①结直肠癌原发灶能够或已经根治性切除。
②肝转移灶可切除,且预计术后有足够的肝脏功能。
③患者全身状况允许,没有肝外转移病灶;或仅并存肺部结节性病灶。
(2)肝转移灶手术禁忌证。
①结直肠癌原发灶不能获得根治性切除。
②出现不能切除的肝外转移灶。
③预计术后余肝体积不足。
④患者全身状况不能耐受手术。
(3)手术治疗。
①同时性肝转移如条件许可,可达到根治性切除的,建议结直肠癌原发灶和肝转移灶同步切除。
②术前评估不能满足原发灶和肝转移灶同步切除条件的同时性肝转移,先手术切除结直肠癌原发灶,肝转移灶的切除可延至原发灶切除后3个月内进行。急诊手术不推荐原发结直肠癌原发灶和肝脏转移灶同步切除。
③结直肠癌根治术后发生肝转移,既往结直肠癌原发灶为根治性切除且不合并原发灶复发,肝转移灶能完全切除且肝切除比例<70%(无肝硬化者),应当手术切除肝转移灶。
④肝转移灶切除术后复发达到手术条件的,可进行2次甚至多次肝转移灶切除。
(4)射频消融:射频消融是根除肝转移灶的手段之一,但局部复发率较高。一般要求接受射频消融的转移灶最大径<3 cm,且一次最多消融3个转移灶。对于肝转移灶切除术中预计余肝体积过小时,也建议对剩余最大径<3 cm的转移灶联合射频消融治疗。
(5)立体定向放疗:立体定向放疗是肝转移灶可选的根治性治疗手段之一,给予病灶高精度、高剂量照射,无创、耐受性好且有效。推荐肝转移灶接受立体定向放疗的指征如下。
①肝转移灶数目≤3个,最大转移灶的最大径≤5 cm。
②原发灶控制稳定,无肝外转移灶或肝外转移灶较小。
③预期生存时间≥3个月。
④肝脏未接受过放疗,且正常肝组织体积>700 ml。
⑤患者一般情况好,血清肝酶水平正常或低于正常值上限的200%,凝血功能正常,Child-Pugh分级A或B级。
推荐对于大多数肝转移灶尤其是最大径≤3 cm者,在安全的前提下采用生物有效剂量≥100 Gy的立体定向放疗。立体定向放疗不适用于与重要器##官如小肠、胃、十二指肠、肾脏等紧密相邻的肝转移灶。不推荐在无图像引导技术、无呼吸控制技术的医疗中心开展肝转移灶立体定向放疗。
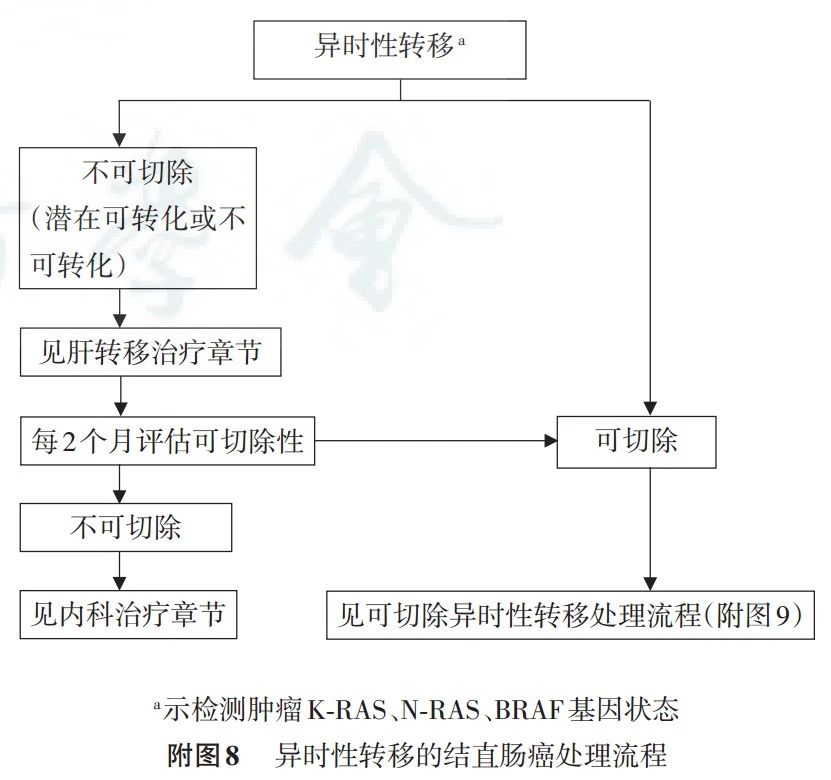
7.2 潜在可切除肝转移的治疗
必须经过多学科讨论制定治疗方案,建议全身化疗或联合靶向药物或其他治疗后再次评估,转化为可切除肝转移灶者,按可切除治疗方案处理,仍为不可切除者,参见内科治疗中复发及转移性结直肠癌化疗章节。
7.3 不可切除肝转移的治疗
7.3.1 原发灶的处理
(1)结直肠癌原发灶无出血、梗阻症状或无穿孔时可以行全身化疗,也可选择先切除结直肠癌原发灶,继而进一步治疗。
(注:对于结直肠癌原发灶无出血、梗阻症状或无穿孔但合并始终无法切除的肝或肺转移的患者是否必须切除原发灶目前仍有争议。)
(2)结直肠癌原发灶存在出血、梗阻症状或穿孔时,应先切除原发灶,继而全身化疗,参见内科姑息治疗章节。治疗后每6~8周予以评估,决定下一步治疗方案。
7.3.2 射频消融
推荐以下情况考虑射频消融:①一般情况不适宜或不愿意接受手术治疗的可切除结直肠癌肝转移患者;②预计术后余肝体积过小时,可先切除部分较大的肝转移灶,对剩余最大径<3 cm的转移灶进行射频消融。
7.3.3 放疗
对于无法手术切除的肝转移灶,如全身化疗、动脉灌注化疗或射频消融治疗无效,可考虑放疗。
八、肺转移的治疗
由于肺转移灶数量、位置、大小,原发灶、肺外转移及基因分型等多种因素均影响肺转移的预后与治疗决策,因此需要通过多学科讨论进行综合治疗。治疗手段包括全身系统治疗、根治性局部治疗(如R0手术切除、立体定向放疗、消射频融等)和局部姑息治疗。多学科讨论中应结合患者临床特点和医疗资源可及性,确定治疗目的,从而制定合理有序的综合治疗策略;在治疗过程中,要关注肿瘤的生物学行为、对治疗的反应及肺外转移灶情况,及时调整治疗预期和方案。
8.1 可切除肺转移的治疗
8.1.1 新辅助及辅助治疗
参见肝转移治疗章节,但目前对于肺转移灶切除后是否需行化疗仍有争议。
8.1.2 局部治疗
影像学诊断可作为手术依据,不需要组织病理学及经皮针刺活检病理学诊断证据。当影像学检查提示转移灶不典型等其他病情需要时,应通过组织病理学对转移灶加以证实,或密切观察以佐证。
(1)手术治疗原则。
①原发灶必须能根治性切除。
②肺外有不可切除病灶时不建议行肺转移灶切除。
③肺转移灶切除后余肺必须能维持足够的肺功能。
④某些患者可考虑分次切除。
⑤肺外可切除转移灶可同期或分期处理。
(2)手术时机选择。
肺转移灶切除时机尚无定论。
①即刻手术:可以避免可切除灶进展为不可切除灶,或肿瘤播散。
②延迟手术:因肺的多发转移较常见,对单个微小结节可留3个月的窗口观察期,可能避免重复性手术。
③对于同期可切除肺及肝转移灶的患者,如身体情况允许可行同时肝、肺转移灶切除。对于不能耐受同期切除的患者,建议按先肝后肺的顺序进行切除。
(3)手术方式。
常用的方式为楔形切除,其次为肺段切除、肺叶切除及全肺切除。纳米激光切除适用于多部位或转移灶深在的患者。
肺转移复发率高,如复发灶可切除,条件合适的患者可进行2次甚至多次切除,能够有效延长患者生存时间。
(4)射频消融。
对于转移灶小(最大径<3 cm)、远离大血管的肺转移灶,射频消融表现出良好的局部控制率(约90%)。
(5)立体定向放疗。适应证如下。
①肺转移灶数目1~3枚,小转移灶≤5枚;最大径≤5 cm。
②肺转移灶分布相对局限,在同一侧肺最优;周围型肺转移灶更适合立体定向放疗。
③原发灶控制稳定,无肺外转移灶或肺外转移灶已控制。
④患者一般情况好,肺功能正常。
⑤预期生存时间≥6个月。
推荐在安全的前提下,生物有效剂量≥100 Gy。推荐利用不同技术限制或追踪肺转移灶的动度,在每次立体定向放疗前通过图像引导系统确认肺转移灶的准确位置。不推荐在无图像引导技术、无呼吸控制技术的医疗中心开展肺转移灶立体定向放疗。
8.2 不可手术切除肺转移的治疗
参见结直肠癌肝转移相关章节。
九、腹膜转移的治疗
结直肠癌确诊的腹膜转移为同时性腹膜转移;异时性腹膜转移为结直肠癌根治术后发生的腹膜转移。腹膜转移通常预后较差,以全身系统治疗为主(具体药物选择参见复发及转移性结直肠癌全身系统治疗章节)。在有经验的医疗中心,根据患者肿瘤负荷、腹腔积液情况、体力评分等因素,在多学科讨论指导下可考虑行以下局部治疗方式。
(1)肿瘤细胞减灭术:全腹膜切除术(前壁腹膜、左右侧壁腹膜、盆底腹膜、膈面腹膜的完整切除,肝圆韧带、镰状韧带、大网膜、小网膜的切除,肠表面、肠系膜、脏层腹膜肿瘤的剔除和灼烧)、联合器##官切除(胃、部分小肠、结直肠、部分胰腺、脾脏、胆囊、部分肝脏、子宫、卵巢、肾脏、输尿管等)。
(2)腹腔热灌注化疗:联合或不联合肿瘤细胞减灭术,选择开放式或闭合式腹腔热灌注化疗。
十、局部复发直肠癌的治疗
10.1 分型
建议根据盆腔受累的解剖部位分为中心型(包括吻合口、直肠系膜、直肠周围软组织、腹会阴联合切除术后会阴部)、前向型(侵及泌尿生殖系统包括膀胱、阴道、子宫、精囊腺、前列腺)、后向型(侵及骶骨、骶前筋膜)、侧方型(侵犯盆壁软组织或骨性骨盆)。
10.2 治疗原则
对患者和病变的具体情况下评估,对于初始可切除患者建议进行以手术治疗为主联合围手术期放化疗的综合治疗,对于初始不可切除的患者建议行放化疗和(或)全身系统治疗,治疗后评估手术可切除性。
10.3 手术治疗
10.3.1 可切除性的评估
必须在术前评估复发病灶得到根治性切除的可能性。推荐根据复发范围考虑决定是否使用新辅助放化疗。建议根据术中探查结果核实病灶的可切除性,必要时可行术中冰冻病理学检查。不可切除的局部复发病灶包括以下情况。
(1)广泛的盆腔侧壁侵犯。
(2)髂外血管受累。
(3)肿瘤侵至坐骨大切迹、坐骨神经受侵。
(4)侵犯S2水平及以上。
10.3.2 手术原则
(1)推荐由结直肠外科专科医师根据患者和病变的具体情况选择适当的手术方案,并与新辅助放化疗、术中放疗、辅助放化疗等结合使用。
(2)推荐必要时与泌尿外科、骨科、血管外科、妇产科医师等共同制订手术方案。
(3)手术探查必须由远及近,注意排除远处转移。
(4)必须遵循整块切除原则,尽可能达到R0切除。
(5)术中注意保护输尿管(酌情术前放置输尿管支架)及尿道。
10.3.3 可切除的病灶手术方式
手术方式包括低位前切除术、腹会阴联合切除术、Hartmann手术及盆腔清扫术等。
(1)中心型:建议行腹会阴联合切除术以保证达到R0切除;既往行保肛手术的患者在病变较为局限的情况下可考虑低位前切除术。腹会阴联合切除术后会阴部术野复发如病变局限可考虑行经会阴或经骶切除术。
(2)前向型:患者身体情况可以耐受手术,可考虑切除受侵犯器##官,行后半盆清扫或全盆腔器##官切除术。
(3)侧向型:切除受累的输尿管、髂内血管及梨状肌。
(4)后向型:腹骶联合切除受侵骶骨。会阴部切口可使用大网膜覆盖或一期缝合。必要时使用肌皮瓣或生物材料补片。
10.4 放疗原则
对于既往未接受过盆腔放疗的患者,推荐行术前同步放化疗(尽量在放疗前取得复发病灶的病理学诊断),再考虑行手术;局部病灶可切除者,也可考虑先行手术,然后再考虑是否行术后放化疗;也可根据既往放化疗方案考虑是否先行放化疗,然后再行手术。既往接受过盆腔放疗的患者原则上不再进行放疗,建议多学科讨论,制定最合理的治疗方案。
10.5 内科药物治疗原则
初始可切除的复发患者,根据患者既往放化疗史,决定围手术期药物治疗方案。
初始不可切除复发患者,根据既往放疗史及治疗目标,经多学科讨论决定放化疗和(或)全身系统治疗。治疗后,经多学科讨论再次评估手术可切除性。
十一、肠造口康复治疗
11.1 人员、任务、架构
有条件的医疗中心推荐配备造口治疗师(专科护士)。造口治疗师的职责包括所有造口(肠造口、胃造口、尿路造口、气管造口等)术前术后的护理、复杂切口的处理、大小便失禁的护理、开设造口专科门诊、联络患者及其他专业人员和造口用品商、组织造口联谊会并开展造口访问者活动。
11.2 术前心理治疗
推荐向患者充分解释有关的诊断、手术和护理知识,让患者接受患病的事实,并对即将发生的事情有全面的了解。
11.3 术前造口定位
推荐术前由医师、造口治疗师、家属及患者共同选择造口部位。
(1)要求:患者自己能看到,方便护理;有足够的粘贴面积;造口器材贴于造口皮肤时无不适感觉。
(2)常见肠造口位置见图3。
11.4 肠造口术后护理
(1)术后要注意观察造口的血运期有无回缩等情况。
(2)造口用品应当具有轻便、透明、防臭、防漏和保护周围皮肤的性能,患者佩戴合适。
(3)保持肠造口周围皮肤的清洁干燥。长期服用抗菌药物、免疫抑制剂和糖皮质激素的患者,应特别注意肠造口部位真菌感染。
十二、随访
结直肠癌治疗后推荐规律随访。
(1)病史和体检,以及癌胚抗原、CA19-9监测,每3个月1次,共2年,然后每6个月1次,总共5年,5年后每年1次。
(2)胸部、腹部及盆腔CT或MRI,每6个月1次,共2年,然后每年1次,共5年。
(3)术后1年内行肠镜检查,如有异常,1年内复查;如未见息肉,3年内复查,然后5年1次;随访发现的结直肠腺瘤均推荐切除。如术前肠镜未完成全结肠检查,建议术后3~6个月行肠镜检查。
(4)PET-CT不是常规推荐的检查项目,对已有或疑有复发及远处转移的患者,可考虑行PET-CT,以排除复发转移。
国家卫生健康委《中国结直肠癌诊疗规范(2020版)》专家组
总顾问:孙燕
顾问:郑树、万德森
组长:顾晋、汪建平
外科组:(组长)顾晋、汪建平、张苏展、蔡三军;(组员)于跃明、王锡山、王贵英、王自强、兰平、孔大陆、许剑民、邱辉忠、叶颖江、宋纯、张忠涛、赵任、徐忠法、贾宝庆、傅传刚、裴海平、潘志忠、房学东、燕锦;(秘书)刘骞、练磊、彭亦凡
内科组:(组长)沈琳、徐瑞华、李进;(组员)巴一、邓艳红、白春梅、白莉、刘天舒、刘云鹏、李健、张艳桥、周爱萍、徐建明、陶敏、袁响林、袁瑛、潘宏铭;(秘书)王峰、王晰程
放疗组:(组长)李晔雄、章真;(组员)王仁本、朱远、朱莉、刘士新、李永恒、吴君心、张红雁、金晶、高远红、蔡勇;(秘书)唐源
病理组:(组长)梁智勇;(组员)孙宝存、邱志强、金木兰、梁莉、盛伟琪、薛卫成;(秘书)周炜洵
影像组:(组长)孙应实;(组员)于韬、王屹、张晓燕、周智洋、董江宁;(秘书)王娟、孙瑞佳
秘书组:(组长)彭亦凡、王晰程;(组员)王峰、王娟、刘骞、孙瑞佳、周炜洵、练磊、唐源
(组员与秘书均分别以姓氏笔画为序)
附录:AJCC第8版结直肠癌分期系统
原发肿瘤(T)
Tx:原发肿瘤无法评价
T0:无原发肿瘤证据
Tis:原位癌:黏膜内癌(侵犯固有层,未侵透黏膜肌层)
T1:肿瘤侵犯黏膜下层
T2:肿瘤侵犯固有肌层
T3:肿瘤侵透固有肌层达结直肠周组织
T4:肿瘤侵犯脏层腹膜,或者侵犯或粘连邻近器##官或结构
T4a:肿瘤侵透脏层腹膜(包括大体肠管通过肿瘤穿孔和肿瘤通过炎性区域连续浸润脏层腹膜表面)
T4b:肿瘤直接侵犯或粘连邻近器##官或结构
区域淋巴结(N)
Nx:区域淋巴结无法评价
N0:无区域淋巴结转移
N1∶1~3枚区域淋巴结转移(淋巴结内肿瘤最大径≥0.2 mm),或存在任何数量的肿瘤结节并且所有可辨识的淋巴结无转移
N1a:1枚区域淋巴结转移
N1b:2~3枚区域淋巴结转移
N1c:无区域淋巴结转移,但有肿瘤结节存在于浆膜下、肠系膜或无腹膜覆盖的结肠周或直肠周及直肠系膜组织
N2∶4枚以上区域淋巴结转移
N2a:4~6枚区域淋巴结转移
N2b:7枚及以上区域淋巴结转移
远处转移(M)
M0:无远处转移
M1:转移至一个或更多远处部位或器##官,或腹膜转移被证实
M1a:转移至一个部位或器##官,无腹膜转移
M1b:转移至两个或更多部位或器##官,无腹膜转移
M1c:仅转移至腹膜表面或伴其他部位或器##官的转移
附表1 AJCC第8版结直肠癌分期系统对应表
附图
附图
附表
温馨提示:
本文章出于传递更多信息之目的,仅供读者参考,并不意味着本站赞同其观点或证实其描述,一切诊断和治疗请遵从医生的指导。如果还有其他疑问,您可以拨打免费长途电话400-6000-838进行咨询,或者直接联系我们。